Kako baterije delujejo in delujejo
 V najširšem pomenu besede v tehnologiji se izraz "baterija" nanaša na napravo, ki v določenih pogojih delovanja omogoča kopičenje določene vrste energije, v drugih pa jo uporablja za človeške potrebe.
V najširšem pomenu besede v tehnologiji se izraz "baterija" nanaša na napravo, ki v določenih pogojih delovanja omogoča kopičenje določene vrste energije, v drugih pa jo uporablja za človeške potrebe.
Uporabljajo se tam, kjer je potrebno določen čas zbirati energijo in jo nato uporabiti za izvajanje velikih delovno intenzivnih procesov. Na primer, hidravlični akumulatorji, ki se uporabljajo v zapornicah, omogočajo ladjam, da se dvignejo na novo raven na rečni strugi.
Električne baterije delujejo z elektriko po enakem principu: najprej akumulirajo (akumulirajo) elektriko iz zunanjega polnilnega vira in jo nato predajo priključenim porabnikom, da opravijo delo. Po svoji naravi spadajo med kemične vire toka, ki lahko izvajajo periodične cikle praznjenja in ponavljajočega se polnjenja.
Med delovanjem nenehno potekajo kemične reakcije med komponentami elektrodnih plošč z njihovim polnilom - elektrolitom.
Shematski diagram baterijske naprave je lahko predstavljen s poenostavljeno risbo, ko sta dve plošči iz različnih kovin z žicami vstavljeni v telo posode, da zagotovita električne kontakte. Med plošče se vlije elektrolit.
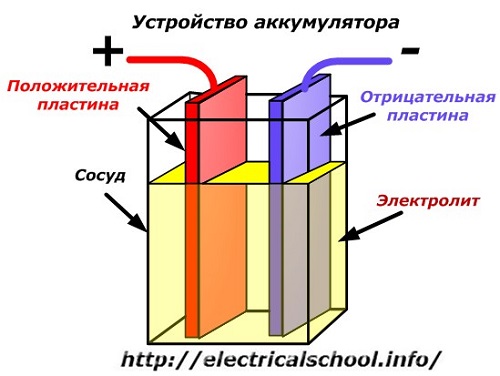
Delovanje baterije, ko je izpraznjena
Ko na elektrode priključimo obremenitev, na primer žarnico, nastane sklenjen električni krog, skozi katerega teče razelektritveni tok. Nastane z gibanjem elektronov v kovinskih delih in anionov s kationi v elektrolitu.
Ta postopek je običajno prikazan na diagramu z zasnovo nikelj-kadmijeve elektrode.
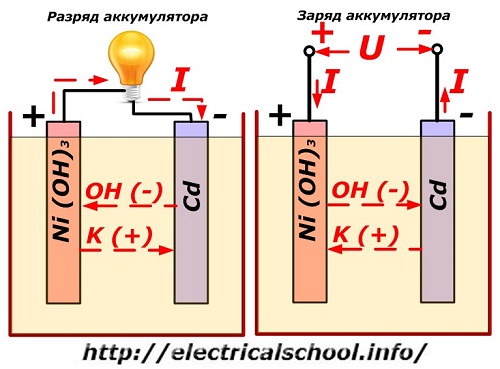
Pri tem se kot material pozitivne elektrode uporabljajo nikljevi oksidi z dodatki grafita, ki povečajo električno prevodnost. Kovina negativne elektrode je gobast kadmij.
Med praznjenjem se delci aktivnega kisika iz nikljevih oksidov sprostijo v elektrolit in usmerijo na negativne plošče, kjer pride do oksidacije kadmija.
Zmogljivost baterije med polnjenjem
Ko je obremenitev izklopljena, se konstantna (v določenih situacijah pulzirajoča) napetost uporablja na sponkah plošče z večjo vrednostjo kot pri napolnjeni bateriji iste polarnosti, ko plus in minus terminala vira in potrošnika sovpadata. .
Polnilec ima vedno večjo moč, ki "zatre" preostalo energijo v bateriji in ustvari električni tok v nasprotni smeri praznjenja. Posledično se spremenijo notranji kemični procesi med elektrodami in elektrolitom. Na primer, na škatli nikelj-kadmijevih plošč je pozitivna elektroda obogatena s kisikom, negativna pa do stanja čistega kadmija.
Pri praznjenju in polnjenju akumulatorja se spremeni kemična sestava materiala plošč (elektrod), ne spremeni pa se elektrolit.
Načini priključitve baterije
Vzporedna povezava
Količina razelektritvenega toka, ki ga človek lahko prenese, je odvisna od številnih dejavnikov, predvsem pa od zasnove, uporabljenih materialov in njihovih dimenzij. Večja kot je površina plošč na elektrodah, večji tok lahko prenesejo.
To načelo se uporablja za vzporedno povezovanje celic istega tipa v baterijah, ko je potrebno povečati tok do obremenitve.Toda za polnjenje takšne zasnove bo potrebno povečati moč vira. Ta metoda se redko uporablja za že pripravljene strukture, saj je zdaj veliko lažje takoj kupiti potrebno baterijo. Toda proizvajalci kislinskih baterij ga uporabljajo, povezujejo različne plošče v posamezne bloke.
Serijska povezava
Odvisno od uporabljenih materialov se lahko ustvari napetost 1,2 / 1,5 ali 2,0 volta med dvema elektrodnima ploščama baterij, ki so običajne v vsakdanjem življenju. (Pravzaprav je ta razpon veliko širši.) Očitno ne zadošča za veliko električnih naprav. Zato so baterije istega tipa povezane zaporedno, kar se pogosto izvaja v enem primeru.
Primer takšne zasnove je razširjen avtomobilski razvoj, ki temelji na žveplovi kislini in svinčenih elektrodnih ploščah.
Običajno je med ljudmi, zlasti med vozniki prevoznikov, običajno, da katero koli napravo imenujemo baterija, ne glede na število njenih sestavnih elementov - škatel. Vendar to ni povsem pravilno.Struktura, sestavljena iz več zaporedno povezanih škatel, je že baterija, za katero je pritrjeno skrajšano ime «АКБ» ... Njena notranja struktura je prikazana na sliki.
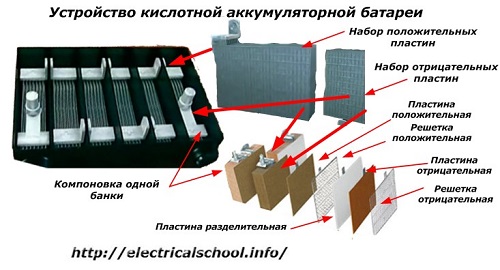
Vsak kozarec je sestavljen iz dveh blokov z nizom plošč za pozitivno in negativno elektrodo. Bloki se prilegajo drug v drugega brez kovinskega stika z možnostjo zanesljive galvanske povezave preko elektrolita.
V tem primeru imajo kontaktne plošče dodatno mrežo in so med seboj ločene z ločilno ploščo.
Povezovanje plošč v bloke poveča njihovo delovno površino, zmanjša skupni upor celotne konstrukcije in vam omogoča povečanje moči priključene obremenitve.
Na zunanji strani škatle ima taka baterija elemente, prikazane na spodnji sliki.
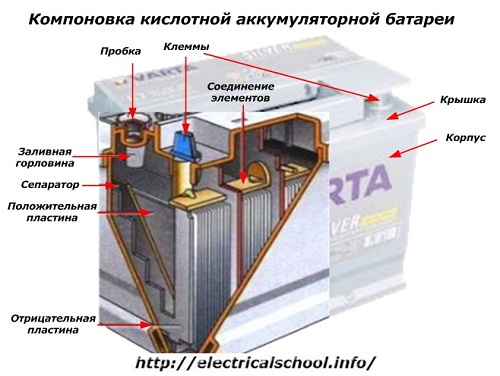
Prikazuje, da je trdno plastično ohišje zaprto s pokrovom in opremljeno z dvema sponkama (običajno v obliki stožca) na vrhu za povezavo z električnim tokokrogom avtomobila. Na njihovih sponkah so vtisnjene oznake polarnosti: «+» in «-». Običajno ima pozitivni priključek nekoliko večji premer kot negativni priključek, da prepreči napake pri ožičenju.
Baterije, ki jih je mogoče servisirati, imajo odprtino za polnjenje na vrhu vsakega kozarca za nadzor nivoja elektrolita ali dodajanje destilirane vode med delovanjem. Vanj je privit čep, ki ščiti notranje votline ohišja pred kontaminacijo in hkrati preprečuje razlitje elektrolita, ko je baterija nagnjena.
Ker je pri močnem polnjenju možno plinenje iz elektrolita (in ta proces je možen med intenzivno vožnjo), so v čepih narejene luknje, ki preprečujejo povečanje tlaka v škatli.Skozi njih izstopata kisik in vodik ter hlapi elektrolitov. Priporočljivo je, da se izogibate takšnim situacijam, ki vključujejo previsoke polnilne tokove.
Na isti sliki je prikazana povezava elementov med bankami in razporeditev elektrodnih plošč.
Avtomobilski startni akumulatorji (svinčeno kislinski) delujejo na principu dvojnega sulfatiranja. Med praznjenjem / polnjenjem na njih poteka elektrokemični proces, ki ga spremlja sprememba kemične sestave aktivne mase elektrod s sproščanjem / absorpcijo vode v elektrolitu (žveplova kislina).
To pojasnjuje povečanje specifične teže elektrolita med polnjenjem in zmanjšanje, ko je baterija prazna. Z drugimi besedami, vrednost gostote vam omogoča oceno električnega stanja baterije. Za merjenje se uporablja posebna naprava - avtomobilski hidrometer.
Destilirana voda, ki je del elektrolita kislinskih akumulatorjev, se pri negativnih temperaturah spremeni v trdno stanje - led, zato je treba za preprečitev zmrzovanja avtomobilskih akumulatorjev v hladnem vremenu uporabiti posebne ukrepe, ki jih določa pravilnik. za izkoriščanje.
Katere vrste baterij obstajajo?
Sodobna proizvodnja za različne namene proizvaja več kot tri ducate izdelkov z različno sestavo elektrod in elektrolita. 12 znanih modelov deluje samo na litij.

Kot elektrodna kovina je mogoče najti naslednje:
-
svinec;
-
železo;
-
litij;
-
titan;
-
kobalt;
-
kadmij;
-
nikelj;
-
cink;
-
srebro;
-
vanadij;
-
aluminij
-
nekaj drugih predmetov.
Vplivajo na karakteristike električnega izhoda in s tem na uporabo.
Sposobnost prenašanja kratkotrajnih visokih obremenitev, ki so posledica vrtenja ročičnih gredi motorjev z notranjim zgorevanjem z električnimi zaganjalniki, je značilna za svinčeve akumulatorje. Široko se uporabljajo v transportu, neprekinjenem napajanju in sistemih zasilnega napajanja.
Standardno galvanske celice (navadne baterije) običajno zamenjajo nikelj-kadmijeve, nikelj-cinkove in nikelj-metal-hidridne baterije.
Toda litij-ionske ali litij-polimerne zasnove zanesljivo delujejo v mobilnih in računalniških napravah, gradbenih orodjih in celo električnih vozilih.
Glede na vrsto uporabljenega elektrolita so baterije:
-
kislo
-
alkalno.
Obstaja razvrstitev baterij glede na namen. Na primer, v sodobnih razmerah so se pojavile naprave, ki se uporabljajo za prenos energije - polnjenje drugih virov. Lastnikom številnih mobilnih naprav v odsotnosti izmeničnega električnega omrežja pomaga tako imenovana zunanja baterija. Zmožen je večkratnega polnjenja tablice, pametnega telefona, mobilnega telefona.
Vse te baterije imajo enak princip delovanja in podobno napravo. Na primer, model litij-ionskega prsta, prikazan na spodnji sliki, v mnogih pogledih ponavlja zasnovo kislinskih baterij, o katerih smo govorili prej.
Tukaj vidimo iste kontaktne elektrode, plošče, separator in ohišje. Le ti so izdelani ob upoštevanju drugih delovnih pogojev.
Osnovne električne lastnosti akumulatorja
Na delovanje naprave vplivajo parametri:
-
zmogljivost;
-
energijska gostota;
-
samopraznjenje;
-
temperaturni režim.
Kapaciteta se imenuje največja napolnjenost baterije, ki jo je sposobna dati med praznjenjem do najnižje napetosti. Izražen je v pendantih (sistem SI) in amper urah (nesistemska enota).
Kot vrsta kapacitete obstaja »energijska kapaciteta«, ki določa količino energije, ki se sprošča pri praznjenju do najmanjše dovoljene napetosti. Meri se v joulih (SI) in vatnih urah (enote, ki niso enote SI).
Gostota energije, izražena kot razmerje med količino energije in težo ali prostornino baterije.
Samopraznjenje upošteva izgubo zmogljivosti po polnjenju brez obremenitve na sponkah. To je odvisno od zasnove in se zaradi številnih razlogov poslabša zaradi okvar izolacije med elektrodama.
Delovna temperatura vpliva na električne lastnosti in v primeru večjih odstopanj od norme, ki jo je določil proizvajalec, lahko poškoduje baterijo. Toplota in mraz sta nesprejemljiva, vplivata na potek kemičnih reakcij in pritisk okolja v škatli.
